Prácticas de inspección visual de equipos tras una operación de limpieza
Puntos clave:
- Se requiere una inspección visual para confirmar que el equipo está libre de residuos visibles.
- Se acepta “visualmente limpio”, pero las definiciones varían si los procedimientos están justificados.
- Tanto las superficies directas como las indirectas requieren herramientas para una inspección visual eficaz.
- Los métodos validados deben respaldar la inspección visual, garantizando una limpieza exhaustiva.
- Los límites de visibilidad definen la detección de la contaminación para una inspección uniforme.
Las directrices reglamentarias y compendiales exigen que los fabricantes confirmen que los equipos de proceso están visualmente limpios tras una operación de limpieza. Una encuesta realizada recientemente por STERIS ha puesto de manifiesto que las prácticas de inspección visual de los equipos limpios difieren de un fabricante a otro. Al mismo tiempo, la encuesta indicaba que, aunque las prácticas e incluso la terminología pueden diferir, esto puede ser aceptado por los reguladores siempre que los procesos estén bien documentados.
En primer lugar, un comentario sobre terminología; muchas directrices reglamentarias y documentos técnicos del sector utilizan diferentes términos para describir el paso que confirma que el equipo de proceso está visualmente limpio después de la limpieza. Para los efectos del presente artículo, los autores utilizan el término “inspección visual”. Otros términos comunes para este paso son “verificación visual” o “examen visual”. Tenga en cuenta que, en este caso, “inspección visual” no se refiere a la comprobación visible de la presencia de partículas en el producto acabado.
A la encuesta respondieron 39 personas, representantes de numerosas empresas farmacéuticas y biofarmacéuticas europeas (27 empresas en 34 centros diferentes). Los fabricantes que completaron la encuesta pertenecen a los siguientes ámbitos: 54 % no estériles (por ejemplo, comprimidos, líquidos, productos combinados), 13 % estériles (por ejemplo, biotecnología, líquidos y productos liofilizados), 26 % vacunas, 5 % dispositivos médicos, 2 % otros (por ejemplo, producción clínica temprana).
El Anexo europeo 15 establece que “una comprobación visual de la limpieza es una parte importante de los criterios de aceptación para la validación de la limpieza” (1). La inspección visual es un paso fundamental para confirmar la eficacia de la limpieza de los equipos de proceso tras la limpieza. El criterio de aceptación para la inspección visual es que esté visualmente limpio. La inspección visual debe incluir las superficies de contacto directo e indirecto con el producto, y requiere que las superficies de los equipos sean visibles. En caso contrario, puede ser necesario desmontar el equipo en cuestión para acceder a él o utilizar herramientas como espejos, fuentes de luz o endoscopios (2, 3). La tecnología moderna, como las cámaras digitales capaces de evaluar la superficie, también puede emplearse en el caso de los recipientes de gran volumen, cuando la inspección visual resulta complicada.
Visualmente limpio es el estándar mínimo esperado. Sin embargo, se aplica un criterio de aceptación adicional, como el límite basado en la salud (1-5). Por lo tanto, un método analítico validado con una sensibilidad inferior al límite de limpieza debe combinarse periódicamente con una inspección visual. Si sólo se aplica la inspección visual para determinar la limpieza del equipo, debe establecerse el umbral a partir del cual el producto es fácilmente visible como residuo (3, 6).
La inspección visual se realiza siempre (en la medida de lo posible) al final de un ciclo de limpieza completo (7). La inspección visual es una observación activa y cualitativa de las superficies en contacto con el producto para confirmar la ausencia de residuos y poder iniciar la producción del siguiente lote (7). ICH Q7: Practice Guidance for Active Pharmaceutical Ingredients establece que: “12.76 ... La inspección visual puede permitir la detección de contaminación manifiesta concentrada en áreas pequeñas que, de otro modo, podrían pasar desapercibidas para el muestreo y/o el análisis”.
Volviendo a la encuesta, el 54 % de los encuestados realiza una inspección visual de la superficie del equipo cuando está seco (Figura 1).
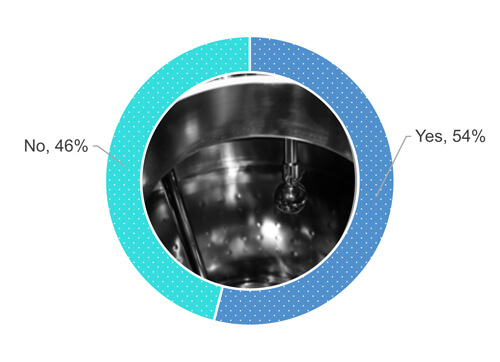
Figura 1 ¿Exige el procedimiento de su empresa que inspeccione visualmente la superficie del equipo de proceso después de una operación de limpieza cuando la superficie está seca?
Algunos documentos técnicos del sector sugieren que la inspección visual se realice sobre una superficie seca, siempre que sea posible, para evitar resultados falsos negativos (8,9):
Active Pharmaceutical Ingredients Committee Guidance (10):
“Después de realizar los procedimientos de limpieza, el equipo debe secarse para permitir la inspección visual”.
“Los criterios de aceptación para la limpieza de equipos deben basarse en el estado visualmente limpio en condiciones secas y en un límite analítico”.
Informe técnico n.º 29 de la PDA: Puntos a tener en cuenta para la validación de la limpieza (9): “Normalmente, las superficies que se examinan visualmente deben estar secas, ya que esto representa el caso más desfavorable para la inspección visual”.
Es sabido que, en el caso de algunos residuos, la limpieza visual solo puede lograrse cuando la superficie está húmeda, mientras que ya no es así cuando la superficie se seca.
El diseño del equipo y los parámetros del ciclo de limpieza pueden conducir a secar las superficies del equipo, como tener las tuberías inclinadas hacia el desagüe, tener capacidad de autodrenaje y que el enjuague final se realice a altas temperaturas. En algunos casos, el soplado de aire limpio en el equipo y en el sistema de distribución puede ayudar a conseguir el nivel de secado requerido en las superficies (9).
Sin embargo, a pesar de que se cumplan los parámetros mencionados, podrían observarse gotas o humedad (“sudor”) en la superficie, lo que puede ser aceptable si se justifica adecuadamente.
Como muestra la Figura 1, el 48 % del 54 % de los encuestados respondió “sí”, cuando se les preguntó si inspeccionan visualmente las superficies del equipo cuando están completamente secas (Figura 2). El 24 % del 54 % permite la presencia de cierta humedad (por ejemplo, gotas aisladas o sudor) en las superficies durante una inspección visual del equipo limpiado (Figura 2). El 19 % del 54 % acepta numerosas gotas pero sin acumulación de agua. El 9 % del 54 % no ha definido los requerimientos en cuando al nivel de secado.
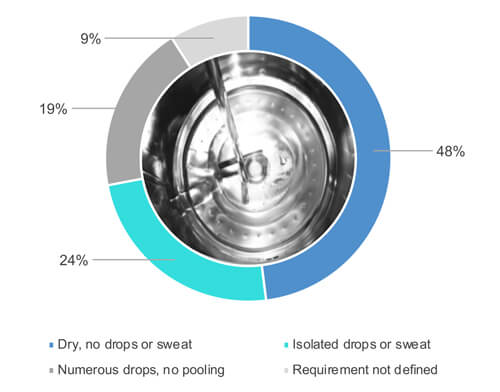
Figura 2 ¿Cuál es el requisito de nivel de secado de los equipos de proceso una vez finalizado el ciclo de limpieza?
Los distintos niveles de secado son aceptables si están adecuadamente justificados y respaldados por datos que demuestren la ausencia de repercusiones en la inspección visual posterior a la limpieza y la proliferación de la carga biológica durante el almacenamiento limpio, por ejemplo, una instrucción y capacitación sólidas que utilicen fotografías para evitar desviaciones. Por último, ninguno del 54 % de los fabricantes que inspeccionan visualmente sus equipos cuando las superficies están secas autorizan que haya agua estancada o acumulada sobre las superficies de los equipos, como se sugiere en Estados Unidos. Guía de inspecciones de la FDA (10): “...Por ejemplo, el equipo debe secarse antes de almacenarse, y bajo ninguna circunstancia debe permitirse que el agua estancada permanezca en el equipo después de las operaciones de limpieza”.
El usuario tiene una gran responsabilidad a la hora de decidir si las superficies del equipo están visualmente limpias. Por lo tanto, los usuarios deben poder inspeccionar visualmente todas las superficies del equipo. Si no fuera posible, debería disponerse de herramientas adecuadas o avanzadas para garantizar la correcta toma de decisiones (2, 3, 9, 11). Una inspección visual de un recipiente grande a través de una mirilla es limitada debido a la superficie oculta. La EMA sugiere que la capacidad de inspeccionar visualmente el equipo, como las distancias observadas sobre el terreno, debe tenerse en cuenta en un documento de preguntas y respuestas (3), y recomienda que “existan instrucciones escritas que especifiquen todas las áreas que requieren inspección visual y que los registros confirmen claramente que se han completado todas las inspecciones”. Por último, los procedimientos detallados y la capacitación sobre los criterios de limpieza visual son obligatorios para garantizar una toma de decisiones correcta. El nivel de capacitación y calificación para la inspección visual debe ser proporcional al riesgo de contaminación cruzada (3, 7, 9, 11).
En cuanto a las fotografías, el 38 % de los encuestados ha definido criterios de limpieza visual añadiendo también fotografías y ejemplos de limpieza (Figura 3). El 46 % se basa en la comprensión de la limpieza visual por parte del usuario, junto con una definición teórica de la limpieza visual en el procedimiento. Por último, el 16 % (3 % y 13 %) se basa en la experiencia y capacitación del usuario (usando soporte específico o imágenes) de una superficie visualmente limpia (Figura 3).
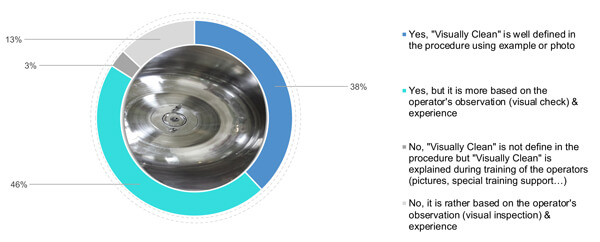
Figura 3 ¿Su empresa define y detalla el significado de los criterios del concepto “visualmente limpio”?
Los usuarios que realizan la inspección visual requieren una formación específica, ya que lo que se puede ver varía en función de la distancia, el ángulo, la iluminación, la naturaleza de la superficie, el nivel de secado y la agudeza visual del inspector (3, 7, 9). La EMA sugiere que las pruebas de visión (o agudeza visual) se realicen periódicamente, y que la competencia del usuario se demuestre mediante una evaluación práctica (3). El Mapa de riesgos de la ISPE sugiere que: “En situaciones en las que el método de detección es únicamente visual, es importante conocer la agudeza visual del personal y qué nivel de residuos se considera seguro (7). Si el nivel de seguridad está por debajo de la agudeza visual del personal, el riesgo de que no se detecte una falla puede considerarse alto, mientras que si el nivel de seguridad está muy por encima (varios órdenes de magnitud) de la agudeza visual del personal, el riesgo de que no se detecte una falla puede considerarse bajo”.
- La frecuencia de la prueba de agudeza visual y el límite de agudeza visual dependerían de variables específicas como:
- la distancia entre el inspector y la superficie del equipo inspeccionado (3, 7, 12)
- la configuración del equipo y la naturaleza de la superficie (7,8)
- las condiciones de iluminación del entorno (3, 7, 9, 12)
- la frecuencia de las pruebas analíticas (3, 7-9, 11,12)
- la toxicidad de los residuos, el límite de limpieza en comparación con el límite de detección visual (3, 6, 7)
- solo se realiza la inspección visual para confirmar la limpieza de un equipo (7)
El 38 % de los encuestados no requiere la certificación o calificación de un usuario (Figura 4). Sin embargo, el 49 % capacita a sus usuarios para que confirmen en campo que un equipo está visualmente limpio (frente al equipo). Por último, el 13 % califica a sus usuarios.
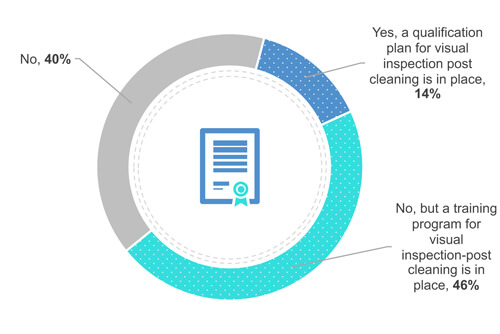
Figura 4 ¿Su empresa cuenta con un programa de certificación o calificación para la inspección visual?
Algunos fabricantes han definido el límite de residuos detectables visualmente, utilizando cupones, que un usuario podría detectar (13, 14). También, algunos de ellos imitaban la distancia entre el usuario y las superficies a inspeccionar en los equipos de proceso (15, 16). Cuando el límite de residuos detectables visualmente es inferior al límite de limpieza, la inspección visual por sí sola como criterio de aceptación puede ser suficiente (7).
¿Una certificación o calificación junto con un programa de capacitación garantiza la competencia de los usuarios para inspeccionar visualmente una superficie? Siguiendo el precepto de ICH Q9: Gestión del riesgo de la calidad (17), la respuesta dependería generalmente de:
el número de desviaciones históricas de las inspecciones visuales debidas a la capacitación del usuario
la dificultad para inspeccionar el equipo (configuración del equipo y entorno ambiental, como iluminación, ángulo, etc.) (3, 7—9, 11, 12, 18, 19)
el tipo de inspección visual que se utiliza; inspección visual cualitativa o cuantitativa (7, 12, 13–16, 18, 19)
la inspección visual no se complementa con pruebas analíticas (13—16, 18)
la frecuencia de las pruebas analíticas realizadas con la inspección visual
la sensibilidad del método analítico frente al límite de limpieza, la toxicidad (basada en el límite de exposición para la salud) de los residuos (1-7, 9, 11)
hacer una doble comprobación
Conclusión
El concepto de inspección visual y los criterios del concepto “visualmente limpio” parecen variar entre los fabricantes europeos en función de su experiencia en la ejecución del proceso de limpieza y la comprensión de los requisitos reglamentarios. El criterio del concepto “visualmente limpio”, sin embargo, debe definirse claramente en los procedimientos. Los usuarios que realizan la inspección visual requieren una capacitación específica, que puede basarse en su propia experiencia.
La variabilidad en las prácticas entre fabricantes, como sugieren los resultados de la encuesta, puede ser aceptable cuando se documenta el riesgo. Siguiendo los requisitos de ICH Q9, el nivel de esfuerzo y formalidad debe ser proporcional al riesgo del paciente.
En la Parte II se presentará un estudio de caso y un requerimiento mínimo sugerido para la inspección visual de superficies limpias.
Los fabricantes europeos interpretan los criterios del concepto “visualmente limpio” de diversas maneras, basándose en su experiencia ejecutando el proceso de limpieza y en sus propias interpretaciones de los requisitos normativos (1). Aun así, debe establecerse un programa formal de capacitación y calificación para la inspección visual, así como instrucciones para prevenir el riesgo de contaminación y verificar que el equipo se limpia de acuerdo con el conjunto de controles del fabricante (2).
La variabilidad en las prácticas entre fabricantes es aceptable. No obstante, los usuarios deben recibir capacitación y calificación periódicas sobre cuándo inspeccionar visualmente los equipos limpios y cómo distinguir entre los residuos de producto y las imperfecciones de la superficie que puedan afectar a los criterios de “visualmente limpio”. El estudio de caso que figura a continuación ilustra por qué esto es importante.
Estudio de caso: Observación de la inspección visual
Recientemente, los inspectores de la FDA de EE. UU. entregaron una observación a un fabricante biofarmacéutico anónimo con respecto a los criterios de limpieza visual. Durante un recorrido por la planta de la empresa, uno de los inspectores revisó la sala aguas arriba donde se ubicaron dos recipientes de fermentación. Los recipientes forman parte de un sistema cerrado y se limpian mediante un sistema de limpieza en el lugar (CIP) totalmente automatizado. El ciclo CIP de uno de los fermentadores terminó una hora antes de que el inspector entrara a la sala aguas arriba. El inspector observó a través de la mirilla del recipiente, notó unas gotas de condensación y que las superficies no estaban brillantes. Esto no convenció al inspector de que el recipiente estaba “visualmente limpio” (Figura 1).

Figura 1 Se detectaron algunas huellas químicas (rastros de decoloración) en la superficie interna del fermentador
Esto llevó a la siguiente observación: “Se observó decoloración en el fermentador (ID del equipo XXXX). Este problema específico no había sido evaluado por la empresa. Este fermentador se utiliza para la fermentación de [nombre del producto]”. [Nota del editor: Las citas proceden del documento normativo resultante].
Esta observación planteó muchas preguntas y afectó a varias estrategias de control. Dado que se produjo después de un ciclo de limpieza en el que se llevó a cabo una inspección visual sistemática (rutinaria), afectó a la estrategia de control de la limpieza y al programa de mantenimiento establecido para garantizar que las superficies del recipiente se encontraban en un estado aceptable. Estos dos programas no coincidían en la forma de inspeccionar y gestionar los recipientes. ¿Qué puede haber más práctico que una inspección visual diaria para confirmar un estado aceptable de la superficie antes de confirmar el estado “visualmente limpio”?
La empresa biofarmacéutica pudo justificar que la presencia de gotas una vez finalizado el proceso CIP era aceptable, fundamentalmente porque el tiempo de mantenimiento limpio (CHT) se validó con éxito en condiciones de limpieza similares. El inspector entendió la situación (que el equipo fue observado inmediatamente después del proceso CIP) y aceptó la justificación.
En cuanto a la decoloración en la pared del recipiente, también había una explicación. Diversas condiciones pueden generar decoloración del acero inoxidable cuando está en contacto con productos específicos, agentes químicos o efectos térmicos. Esto se conoce como el efecto de degradación por intemperismo interno de la superficie. El cambio en la superficie puede modificar las condiciones de la inspección visual, lo que puede alterar la decisión de un inspector (o de un usuario) sobre si la superficie está visualmente limpia, incluso si el fabricante dispone de un proceso de capacitación y calificación de alta calidad.
La observación en sí es clara: la “decoloración... no había sido evaluada” mientras que el equipo se estaba utilizando de manera rutinaria para producir producto biológico a granel. Sin embargo, no se refería a un requisito específico.
¿Cómo respondió la empresa a esta observación?
- La empresa reconoció que la decoloración de la superficie se detectó durante la inspección de la FDA y que no se había evaluado con anterioridad a la misma.
- Se implementó una acción inmediata para investigar la decoloración, se tomaron muestras para su análisis y el fermentador quedó fuera de servicio.
La investigación demostró que la descontaminación de los recipientes mediante agentes cáusticos u otros agentes químicos a altas temperaturas (superiores a 100 °C) provocaba estrés en las paredes de los recipientes y podía causar la aparición de una reacción química en las superficies de acero inoxidable. El electropulido solo restaura temporalmente la superficie de los recipientes. En efecto, los procesos de descontaminación y limpieza han generado desde entonces decoloraciones en las superficies internas del fermentador.
Hay una lección que aprender de esta observación de la FDA: El alcance de la inspección visual realizada por un inspector (por ejemplo, usuarios o técnicos) después de un proceso de limpieza debe estar bien definido. La descontaminación y los procesos de limpieza tienen un impacto duradero en la estructura de los equipos a lo largo del tiempo. Los procesos de limpieza, descontaminación y mantenimiento deben ser consistentes, armonizados y escalonados. Por lo tanto, la estrategia de control de la limpieza y el mantenimiento debe poder hacer frente a los siguientes retos:
- Cómo evaluar y documentar las “imperfecciones visuales” del material que constituye el equipo
- Cómo definir adecuadamente un nivel de secado aceptable antes de la inspección visual
- Cómo capacitar a los inspectores (usuarios, técnicos y expertos en la materia) para detectar superficies visualmente limpias e imperfecciones superficiales?
- Cómo definir una imperfección de la superficie que daría lugar a la exclusión del equipo
- Cómo determinar si el papel de la inspección visual debe incluir el control de las imperfecciones superficiales
Cómo realizar inspecciones para detectar superficies visualmente limpias
La mayoría de los inspectores (usuarios) del sector han estado inspeccionando y aprobando equipos de fabricación basándose en la experiencia (1, 2). Sin embargo, distinguir los restos de producto y las imperfecciones de la superficie puede resultar difícil para los usuarios.
Para resolver este problema, los usuarios deben ser capacitados en equipos fabricados con los mismos materiales y en la misma situación que presenta el residuo o los residuos objetivo que se espera que detecten visualmente. El procedimiento de capacitación y apoyo para garantizar una inspección visual reproducible debe contener, como mínimo, las siguientes secciones:
1. Definición de los criterios de limpieza visual
Visualmente limpio, definido como “la ausencia de residuos visibles en una superficie”, debe definirse adecuadamente como un criterio de aceptación en el procedimiento.
Además de las descripciones, la mejor opción son las imágenes (Figura 2) de superficies visualmente limpias en un procedimiento o curso de capacitación. La inspección visual podría detectar mucho más que los residuos del producto.
Estudios recientes han demostrado que, para inspeccionar visualmente superficies limpias, es importante capacitar al inspector para diferenciar entre residuos en la superficie e imperfecciones o decoloraciones superficiales no críticas (2, 3). En algunos casos, se podría informar a los usuarios del nivel de decoloración o imperfección que es aceptable en las superficies, ya que algunos consideran este control de la superficie como parte del programa de mantenimiento o ingeniería.
El nivel de secado aceptable de los equipos o la categoría y condiciones de drenaje podrían formar parte de la definición o incluirse en una evaluación de riesgos de la limpieza.

Figura 2 Superficies visualmente limpias después de un proceso de limpieza
2. Alcance de la inspección visual
¿Qué superficies deben inspeccionarse visualmente? Deben inspeccionarse visualmente todas las superficies del equipo que entren en contacto directo o indirecto con el producto, el material a granel o el material intermedio. Dado que no todas las superficies de un equipo pueden ser visibles para una inspección visual, el ámbito de aplicación podría adaptarse al tipo de equipo. Debe decidirse cómo y qué inspeccionar visualmente en la superficie.
3. Condiciones del entorno para inspeccionar visualmente una superficie limpia
Las condiciones del entorno del equipo que se va a inspeccionar visualmente influyen en la capacidad de detectar correctamente los residuos, por lo que ese entorno es un elemento importante. La cantidad de residuos detectables (límite de residuos visibles) depende del producto y debe definirse caso por caso o mediante el método de agrupación (2-6).
Para confirmar el impacto de las condiciones del entorno en una inspección visual, deben analizarse los siguientes factores:
Distancia de visualización: La distancia entre la superficie y el usuario. Esta distancia de visualización puede no ser fácil de simular en un laboratorio; sin embargo, el sentido común dicta que cuanto mayor sea la distancia, más difícil será la inspección visual. También influye la agudeza visual del inspector a una distancia determinada.
Niveles de luz (aprox. de 400 a 1500 lux en salas limpias normales): Algunos estudios de cupones han indicado que los niveles de luz entre 200 y 1400 lux puede que no alteren la inspección visual de un inspector; aun así, esto debe demostrarse mediante situaciones reales.
Ángulo de visión: También es preciso tener en cuenta el ángulo de visión entre los ojos del inspector y las superficies que se van a inspeccionar visualmente e integrarlo en el proceso de inspección visual. Según el ángulo y los niveles de luz, un inspector puede ver algunos reflejos que dificultarían la confirmación del estado visualmente limpio.
Luz secundaria: No se recomienda el uso de una linterna cuando las series de validación de la limpieza no se hayan inspeccionado con una linterna. Las condiciones de inspección deben ser similares entre las series de validación y la limpieza y el mantenimiento rutinarios.
Comprender los factores del entorno que pueden afectar a la inspección visual es fundamental para evitar la toma de decisiones inadecuadas.
4. Momento de realización de la inspección visual
Se debe realizar una inspección visual después de una operación de limpieza completa. Al mismo tiempo, esto no suele formar parte de la documentación y puede dar lugar a preguntas sobre la realización de la inspección visual llevada a cabo en caso de que se interrumpa un ciclo de limpieza. El procedimiento debe especificar cuánto tiempo después del final del ciclo de limpieza se debe realizar una inspección visual. Este momento debe determinarse para garantizar la seguridad del usuario al abrir un recipiente (por ejemplo, el paso de subida se realiza generalmente a altas temperaturas). Este momento influye en el proceso de drenaje de agua o disolvente y podría invalidar la inspección de forma prematura.
5. Metodología para realizar inspecciones visuales
Debe establecerse una metodología estructurada para inspeccionar visualmente equipos limpios. Por ejemplo, un fabricante podría elaborar una lista de comprobación que identifique las distintas partes del equipo que deben inspeccionarse visualmente siguiendo un recorrido visual lógico. Además de seguir el método para la inspección visual general, algunos fabricantes han elaborado listas de comprobación en las que se identifican las piezas específicas o los lugares conocidos que presentan mayores problemas y que deben inspeccionarse visualmente.
6. Identificación de los residuos objetivo visibles
Los usuarios deben conocer todos los elementos que pueden examinar durante la inspección visual. Estos elementos pueden ser residuos del producto, imperfecciones de la superficie, daños superficiales, agua residual y partículas, entre otros.
El usuario inspeccionará las superficies visibles con todas sus imperfecciones. También podrán detectar muchos otros elementos o anomalías, empezando por defectos relacionados con el material, su envejecimiento, restos de agua residual, partículas y residuos de productos (Figura 3). Por lo tanto, el objetivo de la inspección visual y los criterios de aceptación deben estar claramente definidos.

Figura 3 Elementos que los usuarios deben detectar en una superficie de contacto directo o indirecto con el producto
El nivel de formalidad en el desarrollo de estas seis secciones depende de la evaluación de riesgos de la limpieza y de las estrategias de control de la empresa.
Conclusión
La inspección visual es el método de elección para confirmar el estado visualmente limpio. La mayoría de los inspectores (usuarios) de todo el sector han estado inspeccionando y aprobando equipos de fabricación basándose en la experiencia (1, 3). Sin embargo, puede resultar difícil para los usuarios distinguir los restos de producto y las imperfecciones de la superficie sin una capacitación y calificación adecuadas. En consecuencia, tiene sentido capacitar adecuadamente a los usuarios y asegurarse de que todos los materiales de construcción y en situación similar se ofrecen para detectar visualmente el residuo o residuos objetivo y las imperfecciones de las superficies que podrían afectar al estado visualmente limpio. Debe establecerse un programa formal de capacitación y calificación para la inspección visual, así como instrucciones. Este programa debe basarse en el conjunto de controles que utiliza el fabricante para verificar que el equipo está limpio. Por lo tanto, la inspección visual definida y calificada podría ser un método de control preliminar para una estrategia de gestión de riesgos de la limpieza.
Ambos autores participaron en la redacción del manuscrito y aprobaron la versión final. La elaboración de este artículo ha sido patrocinada por GlaxoSmithKline Biologicals SA y STERIS. Los autores declaran los siguientes intereses: Walid El Azab es empleado de STERIS, Stéphane Cousin es empleado del grupo de empresas GSK.
Parte 1 Referencias
- Comisión Europea, Buenas prácticas de fabricación de medicamentos de uso humano y veterinario: Anexo 15, calificación y validación, 2015.
- Canada Health Products and Food Branch Inspectorate. Guidance Document. Cleaning validation guidelines: Drug and health products. Health Canada: Ottawa, Canadá; primavera de 2002.
- European Medicines Agency, Questions and answers on implementation of risk-based prevention of cross-contamination in production y ‘Guideline on setting health-based exposure limits for use in risk identification in the manufacture of different medicinal products in shared facilities’ (EMA/CHMP/CVMP/SWP/169430/2012), EMA/CHMP/CVMP/SWP/246844/2018, (abril de 2018)
- European GMP part IV Guidelines on Good Manufacturing Practice specific to Advanced Therapy Medicinal Products
- Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme. Guide to Good Manufacturing Practice for Medicinal Products: Annex 15, 2015.
- Walsh A. et al., “Justification & Qualification Of Visual Inspection For Cleaning Validation In A Low-Risk, Multiproduct Facility.” Pharmaceutical Online (3 de agosto de 2018) consultado en enero de 2020 https://www.pharmaceuticalonline.com/doc/justification-qualification-of-visual-inspection-for-cleaning-validation-in-a-low-risk-multiproduct-facility-0001
- ISPE, ISPE Risk-Based Manufacture of Pharmaceutical Products, second edition, Volume 7
- Active Pharmaceutical Ingredients Committee, guidance on aspects of cleaning validation in active pharmaceutical ingredient plants (2016)
- Parenteral Drug Association, Technical Report 29, Points to Consider for Cleaning Validation (2012)
- GUIDE TO INSPECTIONS VALIDATION OF CLEANING PROCESSES, consultado en septiembre de 2019: https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/inspection-guides/validation-cleaning-processes-793
- Parenteral Drug Association, Technical Report 49, Points to Consider for Biotechnology Cleaning Validation (2010)
- ASTM: E306-18, Standard guide for Science-Based and Risk-Based Cleaning Process Development and Validation, October 2018 version 1.
- Forsyth, R.J., et al. “Visible-Residue Limit for Cleaning Validation and its Potential Application in a Pharmaceutical Research Facility.” Pharmaceutical Technology 28 (1 octubre de 2004) 68–72.
- “Application of Visible-Residue Limit for Cleaning Validation.” Pharmaceutical Technology 28 (2 de octubre de 2005) 10 http://www.pharmtech.com/application-visible-residue-limit-cleaning-valiation?id=&pageID=1&sk=&date= (consultado en septiembre de 2019)
- “Determination of Surface Visible Residue Limits on Pharmaceutical Plant Equipment.” Pharmaceutical Technology 37 (2 de febrero de 2013)
- Desai, P., and Walsh, A. “Validation of Visual Inspection As An Analytical Method For Cleaning Validation.” Pharmaceutical Online (11 de septiembre de 2017) https://www.pharmaceuticalonline.com/doc/validation-of-visual-inspection-as-an-analytical-method-for-cleaning-validation-0001 (consultado en septiembre de 2019)
- International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for human use, Quality Risk Management Q9, (2005)
- Walsh, A., et al., “Justification & Qualification Of Visual Inspection For Cleaning Validation In A Low-Risk, Multiproduct Facility.” Pharmaceutical Online (3 de agosto de 2018) https://www.pharmaceuticalonline.com/doc/justification-qualification-of-visual-inspection-for-cleaning-validation-in-a-low-risk-multiproduct-facility-0001 (consultado en enero de 2020)
Forsyth, R.J., and Hartman, J., “A Risk-based Approach to Cleaning Validation using Visible Residue Limits.” Pharmaceutical Engineering 28 (2008) 8–22.
Parte 2 Referencias
- El Azab W. and Cousin S., “Visual Inspection Practices of Cleaned Equipment: Part I,” consultado en abril de 2020: https://www.pda.org/pda-letter-portal/home/full-article/visual-inspection-practices-of-cleaned-equipment-part-i
- Walsh, A., et al., “Justification & Qualification of Visual Inspection for Cleaning Validation in a Low-Risk, Multiproduct Facility.” Pharmaceutical Online (3 de agosto de 2018) https://www.pharmaceuticalonline.com/doc/justification-qualification-of-visual-inspection-for-cleaning-validation-in-a-low-risk-multiproduct-facility-0001
- Desai, P. and Walsh, A. “Validation of Visual Inspection as an Analytical Method for Cleaning Validation.” Pharmaceutical Online (11 de septiembre de 2017) https://www.pharmaceuticalonline.com/doc/validation-of-visual-inspection-as-an-analytical-method-for-cleaning-validation-0001
- Forsyth, R.J., et al. “Visible-Residue Limit for Cleaning Validation and its Potential Application in a Pharmaceutical Research Facility.” Pharmaceutical Technology 28 (octubre de 2004): 58–72 https://pdfs.semanticscholar.org/ea64/d01db84d3b8a5a62f1c824abf8484af363dd.pdf
- “Application of Visible-Residue Limit for Cleaning Validation.” Pharmaceutical Technology 29 (2 de octubre de 2005) http://www.pharmtech.com/application-visible-residue-limit-cleaning-validation?id=&pageID=1&sk=&date=
- “Determination of Surface Visible Residue Limits on Pharmaceutical Plant Equipment,” Pharmaceutical Technology (2 de febrero de 2013) 37 http://www.pharmtech.com/determination-surface-visible-residue-limits-pharmaceutical-plant-equipment?id=&pageID=1&sk=&date=
Contenido sugerido
Un proceso justificado para la limpieza y desinfección
Servicios que se deben considerar para la validación de su equipo
Preservación del acero inoxidable: Mitigación del enrojecimiento
Únase a nuestra lista de correo electrónico para recibir las últimas novedades del sector y actualizaciones de productos.
Al hacer clic en Suscribirse confirma que está de acuerdo con nuestras Condiciones.



